Абсолютная температура
Содержание:
- Идеальные газы
- Определение — абсолютная температура
- Температура. Тепловое равновесие. Абсолютная шкала температур. Молекулярная физика
- Как рассчитать точку росы
- Литература
- ФИЗИКА
- § 3.7. Абсолютная температура
- Основные формулы термодинамики и молекулярной физики, которые Вам пригодятся
- Макроскопические и микроскопические тела.
- Приборы для измерения влажности
- Отрицательные температуры
Идеальные газы
Каждый школьник знает, что газ является одним из четырех (включая плазму) агрегатных состояний материи, в котором частицы не имеют определенных положений и движутся хаотичным образом во всех направлениях с одинаковой вероятностью. Исходя из такого строения, газы не сохраняют ни объем, ни форму при малейшем внешнем силовом воздействии на них.
В любом газе средняя кинетическая энергия его частиц (атомов, молекул) больше, чем энергия межмолекулярного взаимодействия между ними. Кроме того, расстояния между частицами намного превышают их собственные размеры. Если молекулярными взаимодействиями и размерами частиц можно пренебречь, тогда такой газ называется идеальным.
В идеальном газе существует лишь единственный вид взаимодействия — упругие столкновения. Поскольку размер частиц пренебрежимо мал в сравнении с расстояниями между ними, то вероятность столкновений частица-частица будет низкой. Поэтому в идеальной газовой системе существуют только столкновения частиц со стенками сосуда.
Все реальные газы с хорошей точностью можно считать идеальными, если температура в них выше комнатной, и давление не сильно превышает атмосферное.
Определение — абсолютная температура
Определения абсолютной температуры были выполнены при помощи нагревания в переменном магнитном поле.
Определения абсолютной температуры были выполнены в Лейдене, где использовался нагрев в переменном поле и гистерезисный нагрев, а также в Оксфорде, где применялись у-лучи.
Определения абсолютной температуры были выполнены в Лейдене при помощи нагревания в переменном магнитном поле п в Оксфорде, где использовались у-лучи. Эксперименты с церемонным полем были выполнены при температурах ниже максимума восприимчивости, поскольку выше него — / было слишком мало.
Определения абсолютной температуры были выполнены при помощи нагревания в неременном магнитном иоле.
Определения абсолютной температуры были выполнены Б Лейдене, где использовался нагрев в переменном поле и гисчерезнспын нагрев, а также л Оксфорде, где применялись у-лучп.
Определения абсолютной температуры были выполнены в Лейдене при помощи нагревания в переменном магнитном ноле п н Оксфорде, где использовались у-лучп. Эксперименты с переменным нолем были выполнены при температурах ниже максимума восприимчивости, поскольку выше него /; было слишком мало.
Из определения абсолютной температуры Т следует, что при температуре абсолютного нуля ( Т 0) тепловое движение молекул прекращается.
Для определения абсолютных температур вблизи нуля шкалы Кельвина выражение ( 33) можно записать в другой более удобной форме.
Для определения абсолютной температуры прежде всего необходим вторичный термометр, который должен быть програ-дуирован по абсолютной шкале температур. При более высоких температурах это не вызывает затруднений. Термометр может быть проградуирован отдельно и затем приведен в тепловой контакт с веществом, температура которого измеряется.
При идеализированном определении абсолютной температуры как меры движения газовых молекул абсолютный нуль определяется как такое состояние, в котором исчезает молекулярное движение. В настоящее время это представление признается неверным, независимо от того, конденсируется ли данный газ при низких температурах, переходя в твердое или жидкое состояние, или нет; однако в этой части курса такое упрощенное представление следует изложить как констатацию факта, не объясняя его подробнее, чем это сделано в Учебнике. Абсолютный нуль-это, по определению, такая температура, при которой любая система находится на самом низком энергетическом уровне, какой только возможен, но это состояние системы вовсе не соответствует полному отсутствию движения.
Из самого определения абсолютной температуры Т следует, что она всегда положительна. При температуре абсолютного нуля ( 7 0) тепловое движение молекул прекращается.
Из самого определения абсолютной температуры следует, что она отрицательной быть не может. За начало отсчета абсолютной температуры принят абсолютный нуль, теоретически определяемый.
Анализ возможностей определения абсолютных температур ниже 1 К был опубликован Джиоком в 1953 г. Автор отметил технические трудности, возникающие в описанном методе, при котором требуется сообщение тепла системе при температурах ниже 1 К, и описал метод, не требующий добавления тепла при этих температурах.
Магнитные методы определения абсолютной температуры в случае этой соли сопряжены с трудностями.
Зависимость ек от Т дает определение абсолютной температуры. Термодинамическая температура является физической величиной, пропорциональной средней кинетической энергии поступательного движения молекул идеального газа.
Температура. Тепловое равновесие. Абсолютная шкала температур. Молекулярная физика
- Подробности
- Просмотров: 719
Температура — это просто!
Температура
Температура — это мера средней кинетической энергии молекул.
Температура характеризует степень нагретости тел.
Прибор для измерения температуры — термометр.Принцип действия термометра:
При измерении температуры используется зависимость изменения какого-либо макроскопического параметра (объема, давления, электрического сопротивления и т.д.) вещества от температуры.
В жидкостных термометрах — это изменение объема жидкости.
При контакте двух сред происходит передача энергии от более нагретой среды менее нагретой.
В процессе измерения температура тела и термометра приходят в состояние теплового равновесия.
Жидкостные термометры
На практике часто используются жидкостные термометры: ртутные (в диапазоне от -35oС до +750oС) и спиртовые (от -80oС до +70oС).
В них используется свойство жидкости изменять свой объем при изменении температуры.
Однако, у каждой жидкости существуют свои особенности изменения объема (расширения) при различных температурах.
В результате сравнения, например, показаний ртутного и спиртового термометров, точное совпадение будет только лишь в двух точках (при температурах 0oС и 100oС).
Этих недостатков лишены газовые термометры.
Газовые термометры
Первый газовый термометр был создан французским физиком Ж. Шарлем.
Преимущества газового термометра:
— используется линейная зависимость изменения объема или давления газа от температуры, которая справедлива для всех газов
— точность измерения от 0,003oС до 0,02oС
— интервал температур от -271oС до +1027oС.
Тепловое равновесие
При соприкосновении двух тел различной температуры происходит передача внутренней энергии от более нагретого тела менее нагретому, и температуры обоих тел выравниваются.
Наступает состояние теплового равновесия, при котором все макропараметры (объем, давление, температура) обоих тел остаются в дальнейшем неизменными при неизменных внешних условиях. Тепловым равновесием называется такое состояние, при котором все макроскопические параметры остаются неизменными сколь угодно долго.
Состояние теплового равновесия системы тел характеризуется температурой: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
Установлено, что при тепловом равновесии средние кинетические энергии поступательного движения молекул всех газов одинаковы, т.е.
Для разреженных (идеальных) газов величина
и зависит только от температуры, тогда
где k — постоянная Больцмана
Эта зависимость дает возможность ввести новую температурную шкалу абсолютную шкалу температур, не зависящую от вещества, используемого для измерения температуры.
Абсолютная шкала температур
— введена английским физиком У. Кельвином
— нет отрицательных температур
Единица абсолютной температуры в СИ: = 1K (Кельвин)
Нулевая температура абсолютной шкалы — это абсолютный ноль ( 0К = -273oС ), самая низкая температура в природе. В настоящее время достигнута самая низкая температура — 0,0001К.
По величине 1К равен 1oC.
Связь абсолютной шкалы со шкалой Цельсия
Запомни! В формулах абсолютная температура обозначается буквой «Т», а температура по шкале Цельсия буквой «t».
После введения абсолютной температуры получаем новые выражения для формул:
Средняя кинетическая энергия поступательного движения молекул
Давление газа — основное уравнение МКТ
Средняя квадратичная скорость молекул
И как следствие, закон Авогадро:
В равных объемах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.Заметьте, здесь концентрация молекул также одинакова!
Следующая страница «Идеальный газ. Основное уравнение МКТ»
Назад в раздел «10-11 класс»
Молекулярная физика. Термодинамика — Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. —
Взаимодействие молекул. Строение твердых тел, жидкостей и газов. —
Идеальный газ. Основное уравнение МКТ. —
Температура. Тепловое равновесие. Абсолютная шкала температур. —
Уравнение состояния идеального газа. —
Изопроцессы. Газовые законы. —
Взаимные превращения жидкостей и газов. Влажность воздуха. —
Твердые тела. Кристаллические тела. Аморфные тела.
Как рассчитать точку росы
По математической формуле
Проведение расчётов вручную по формуле – довольно точный способ. Однако для использования формулы предварительно надо определить несколько других показателей. Выглядит формула следующим образом.
Формула для расчёта точки росы
Как видно из рисунка, a и b – постоянные величины. Т – температура воздуха. Rh – относительная влажность воздуха. Такой метод подсчёта даст результат с погрешностью в 0,5ºС.
С помощью онлайн-калькулятора
Поскольку расчёт с помощью формулы вручную подходит не всем (из-за недостаточных знаний в математике либо отсутствия времени), в сети Интернет в открытом доступе размещены онлайн-калькуляторы, которые рассчитывают точку росы на основании введённой информации. Пользоваться ими совершенно несложно: надо только ввести исходные данные (температура атмосферного воздуха и относительная влажность). Результат расчётов появится на экране.
Программы-калькуляторы
Увязать показатель точки росы и предполагаемые последствия неправильного утепления под силу не каждому. Для этого нужны специфические знания в физике и строительстве. Поэтому помимо обычных калькуляторов, рассчитывающих эту величину, созданы программы с расширенными возможностями. Они также находятся в свободном доступе и ими можно воспользоваться в режиме онлайн.
Такие программы при расчёте учитывают множество параметров:
Населённый пункт, в котором построено (строится) здание. Тут же появляется статистика среднемесячных температур, относительной влажности, давления в этом регионе.
Вид помещения. Очевидно, что влажность воздуха в ванной будет выше, чем в комнате, а это в свою очередь влияет на вид допустимого утеплителя.
Тип конструкции. Здесь на выбор предлагается стена, перекрытие, чердачное перекрытие и другие позиции.
Слои конструкции
Здесь принимается во внимание, что находится за утепляемой стеной – другое помещение либо улица.
Материал перекрытия или стены.
Температура и относительная влажность внутреннего и наружного воздуха.
После заполнения всех необходимых полей программа составит график точки росы.
Таблица определения точки росы
При необходимости быстро получить значение точки росы применяются таблицы. Данные таблиц весьма неточные и дают приблизительный результат. Зато пользоваться ими легко и быстро: достаточно только найти нужную ячейку на пересечении столбца и строки с нужной температурой и относительной влажностью воздуха.
Таблица 1. Определение точки росы по двум показателям.
Определение точки росы по двум показателям
Специальные инструменты
В метеорологии придуманы специальные инструменты, позволяющие определить точку росы. Однако даже для расчёта по математической формуле или любым другим методом, описанным выше, нужны свои инструменты.
Температура измеряется термометром, влажность – гигрометром. Для удобства в данном случае подойдёт инструмент, способный замерять и температуру, и влажность воздуха – цифровой термогигрометр.
Этот инструмент сочетает в себе функции градусника и гигрометра
Кроме того, существуют приборы, сочетающие в себе несколько функций: измерение температуры, влажности, расчёт точки росы и запоминание информации.
В большинстве случаев работа с таким прибором выглядит следующим образом.
Включите прибор
Обратите внимание на заряд батареи. Так выглядит один из популярных приборов. Поднесите наконечник сенсора к исследуемой поверхности под прямым углом
Поднесите наконечник сенсора к исследуемой поверхности под прямым углом
Правильное положение прибора обеспечит точность замеров
Чтобы зафиксировать данные замера, нажмите кнопку Hold в меню. Так Вы сможете ознакомиться с результатом в комфортном положении прибора. Зафиксировать – еще не значит сохранить
Для сохранения данных нажмите кнопку Save. Возможность сохранения избавляет от необходимости записывать данные в блокнот
При необходимости перенести информацию на компьютер подключите прибор к сети через USB. Подключить измеритель точки росы к компьютеру не сложнее, чем мобильный телефон
Скопируйте данные на компьютер. Компьютер – надежное хранилище данных
Работа с приборами для измерения точки росы проста даже для человека без специальной подготовки. Интерфейс интуитивно понятен, а при возникновении вопросов следует обратиться к инструкции.
Литература
- Украинская советская энциклопедия: в 12 томах = Українська радянська енциклопедія (укр.) / За ред. М. Бажана. — 2-ге вид. — К.: Гол. редакція УРЕ, 1974—1985.
- Малая горная энциклопедия. В 3 т. = Мала гірнича енциклопедія / (На укр. яз.). Под ред. В. С. Белецкого. — Донецк: Донбасс, 2004. — ISBN 966-7804-14-3.
- Белоконь Н. И. Термодинамика. — М.: Госэнергоиздат, 1954. — 417 с.
- Белоконь Н. И. Основные принципы термодинамики. — М.: Недра, 1968. — 112 с.
- Кириллин В. А. Техническая термодинамика. — М.: Энергоатомиздат, 1983. — 414 с.
- Вукалович М. П., Новиков И. И. Техническая термодинамика. — М.: Энергия, 1968. — 497 с.
- Сивухин Д. В. Общий курс физики. Т. II. Термодинамика и молекулярная физика. — М.: Физматлит, 2005. — 544 с. — ISBN 5-9221-0601-5.
- Базаров И. П. Термодинамика. — М.: Высшая школа, 1991. — 376 с. — ISBN 5-06-000626-3.
- Різак В., Різак І., Рудавський Е. Кріогенна фізика і техніка. — К.: Наукова думка, 2006. — 512 с. — ISBN 966-00-480-X.
ФИЗИКА
§ 3.7. Абсолютная температура
Не все в мире относительно. Так, существует абсолютный нуль температуры. Есть и абсолютная шкала температур. Сейчас вы узнаете об этом.
При увеличении температуры объем газа неограниченно возрастает. Не существует никакого предела для роста температуры(1). Напротив, низкие температуры имеют предел.
Согласно закону Гей-Люссака (3.6.4), при понижении температуры объем стремится к нулю. Так как объем не может быть отрицательным, то температура не может быть меньше определенного значения (отрицательного по шкале Цельсия).
Абсолютный нуль температуры
Предельную температуру, при которой объем идеального газа становится равным нулю, принимают за абсолютный нуль температуры. Однако объем реальных газов при абсолютном нуле температуры обращаться в нуль не может. Имеет ли смысл тогда это предельное значение температуры?
Предельная температура, существование которой вытекает из закона Гей-Люссака, имеет смысл, так как практически можно приблизить свойства реального газа к свойствам идеального. Для этого надо брать все более разреженный газ, так чтобы его плотность стремилась к нулю. У такого газа действительно объем с понижением температуры будет стремиться к предельному, близкому к нулю.
Найдем значение абсолютного нуля по шкале Цельсия. Приравнивая объем Vb формуле (3.6.4) нулю и учитывая, что
получим
Отсюда абсолютный нуль температуры равен
t = -273°C(2).
Это предельная, самая низкая температура в природе, та «наибольшая или последняя степень холода», существование которой предсказал Ломоносов.
Шкала Кельвина
Английский ученый У. Кельвин ввел абсолютную шкалу температур. Нулевая температура по шкале Кельвина соответствует абсолютному нулю, и единица температуры по этой шкале равна градусу по шкале Цельсия, поэтому абсолютная температура Т связана с температурой по шкале Цельсия формулой

На рисунке 3.11 для сравнения изображены абсолютная шкала и шкала Цельсия.
Рис. 3.11
Единица абсолютной температуры в СИ называется Кельвином (сокращенно К). Следовательно, один градус по шкале Цельсия равен одному градусу по шкале Кельвина: 1 °С = 1 К.
Кельвин Уильям (Томсон У.) (1824— 1907) — выдающийся английский физик, один из основателей термодинамики и молекулярно-кинетической теории газов.
Кельвин ввел абсолютную шкалу температур и дал одну из формулировок второго начала термодинамики в форме невозможности полного превращения теплоты в работу. Он произвел расчет размеров молекул на основе измерения поверхностной энергии жидкости. В связи с прокладкой трансатлантического телеграфного кабеля Кельвин разработал теорию электромагнитных колебаний и вывел формулу для периода свободных колебаний в контуре. За научные заслуги У. Томсон получил титул лорда Кельвина.
Таким образом, абсолютная температура по определению, даваемому формулой (3.7.6), является производной величиной, зависящей от температуры Цельсия и от экспериментально определяемого значения α. Однако она имеет фундаментальное значение.
С точки зрения молекулярно-кинетической теории абсолютная температура связана со средней кинетической энергией хаотического движения атомов или молекул. При T = 0 К тепловое движение молекул прекращается. Подробнее об этом пойдет речь в главе 4.
Зависимость объема от абсолютной температуры
Применяя шкалу Кельвина, закон Гей-Люссака (3.6.4) можно записать в более простой форме. Так как
то
Объем газа данной массы при постоянном давлении прямо пропорционален абсолютной температуре.
Отсюда следует, что отношение объемов газа одной и той же массы в различных состояниях при одном и том же давлении равно отношению абсолютных температур:
Существует минимально возможная температура, при которой объем (и давление) идеального газа обращаются в нуль. Это абсолютный нуль температуры: -273 °С. Удобно отсчитывать температуру от абсолютного нуля. Так строится абсолютная шкала температур.
(1) Наибольшие температуры на Земле — сотни миллионов градусов — получены при взрывах термоядерных бомб. Еще более высокие температуры характерны для внутренних областей некоторых звезд.
(2) Более точное значение абсолютного нуля: -273,15 °С.
Основные формулы термодинамики и молекулярной физики, которые Вам пригодятся
Основные формулы термодинамики и молекулярной физики, которые Вам пригодятся.
Вот он, еще один отличный день для практических занятий по физике. Сегодня, дорогие друзья, мы соберем вместе формулы, которые чаще всего используются при решении задач в термодинамике и молекулярной физике.
Итак, поехали. Попытаемся изложить законы и формулы термодинамики кратко.
Идеальный газ
Идеальный газ – это идеализация, как и материальная точка. Молекулы такого газа являются материальными точками, а соударения молекул – абсолютно упругие. Взаимодействием же молекул на расстоянии пренебрегаем. В задачах по термодинамике реальные газы часто принимаются за идеальные. Так гораздо легче жить, и не нужно иметь дела с массой новых членов в уравнениях.
Итак, что происходит с молекулами идеального газа? Да, они движутся! И резонно спросить, с какой скоростью? Конечно, помимо скорости молекул нас интересует еще и общее состояние нашего газа. Какое давление P он оказывает на стенки сосуда, какой объем V занимает, какая у него температура T.
Для того, чтобы узнать все это, есть уравнение состояния идеального газа, или уравнение Клапейрона-Менделеева
Здесь m – масса газа, M – его молекулярная масса (находим по таблице Менделеева), R – универсальная газовая постоянная, равная 8,3144598(48) Дж/(моль*кг).
Универсальная газовая потоянная может быть выражена через другие константы (постоянная Больцмана и число Авогадро)
Массу, в свою очередь, можно вычислить, как произведение плотности и объема.
Основное уравнение молекулярно-кинетической теории (МКТ)
Как мы уже говорили, молекулы газа движутся, причем, чем выше температура – тем быстрее. Существует связь между давлением газа и средней кинетической энергией E его частиц. Эта связь называется основным уравнением молекулярно-кинетической теории и имеет вид:
Здесь n – концентрация молекул (отношение их количества к объему), E – средняя кинетическая энергия. Найти их, а также среднюю квадратичную скорость молекул можно, соответственно, по формулам:
Подставим энергию в первое уравнение, и получим еще один вид основного уравнения МКТ
Первое начало термодинамики. Формулы для изопроцессов
Напомним Вам, что первый закон термодинамики гласит: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа U и на совершение газом работы A. Формула первого закона термодинамики записывается так:
Как известно, с газом что-то происходит, мы можем сжать его, можем нагреть. В данном случае нас интересуют такие процессы, которые протекают при одном постоянном параметре. Рассмотрим, как выглядит первое начало термодинамики в каждом из них
Изотермический – протекает при постоянной температуре. Тут работает закон Бойля-Мариотта: в изотермическом процессе давление газа обратно пропорционально его объёму. В изотермическом процессе:
Изохорный – протекает при поcтоянном объеме. Для этого процесса характерен закон Шарля: При постоянном объеме давление прямо пропорционально температуре. В изохорном процессе все тепло, подведенное к газу, идет на изменение его внутренней энергии.
Изобарный – идет при постоянном давлении. Закон Гей-Люссака гласит, что при постоянном давлении газа его объём прямо пропорционален температуре. При изобарном процессе тепло идет как на изменение внутренней энергии, так и на совершение газом работы.
Адиабатный процесс. Адиабатный процесс – это такой процесс, который проходит без теплообмена с окружающей средой. Это значит, что формула первого закона термодинамики для адиабатного процесса выглядит так:
Теплоемкость
Удельная теплоемкость равна количеству теплоты, которое необходимо для нагревания одного килограмма вещества на один градус Цельсия.
Помимо удельной теплоемкости, есть молярная теплоемкость (количество теплоты, необходимое для нагревания одного моля вещества на один градус) при постоянном объеме, и молярная теплоемкость при постоянном давлении. В формулах ниже, i – число степеней свободы молекул газа. Для одноатомного газа i=3, для двухатомного – 5.
Тепловые машины. Формула КПД в термодинамике
Тепловая машина, в простейшем случае, состоит из нагревателя, холодильника и рабочего тела. Нагреватель сообщает тепло рабочему телу, оно совершает работу, затем охлаждается холодильником, и все повторяется вновь. Типичным примером тепловой машины является двигатель внутреннего сгорания.
Коэффициент полезного действия тепловой машины вычисляется по формуле
Иван Колобков, известный также как Джони. Маркетолог, аналитик и копирайтер компании Zaochnik. Подающий надежды молодой писатель. Питает любовь к физике, раритетным вещам и творчеству Ч. Буковски.
Макроскопические и микроскопические тела.
Мы живем в макромире, и все предметы, которые нас окружают принято называть макроскопическими телами.
Да может быть ваша любимая кружка в масштабах вселенной кажется не такой уж и большой, чтоб носить приставку макро. Но относительно огромного числа атомов и молекул, из которых она состоит, это название вполне заслуженно.
Сами же атомы и молекулы, а также электроны, протоны, нейтроны принято называть микроскопическими телами или микроскопическими частицами.
Совокупности макроскопических тел или иногда отдельные макроскопические тела называют термодинамическими системами.
Так как эти системы состоят из огромного числа подвижных микроскопических частиц, они способны обмениваться веществом и энергией, как внутри самой системы, так и с окружающей средой.
Только представьте какие процессы происходят в Вашей кружке пока она остывает, дожидаясь Вас на кухне.
И здесь интересный момент. Для описания термодинамической системы не обязательно рассматривать поведение каждой отдельной ее молекулы. Это в принципе невозможно.
Состояние термодинамической системы прекрасно характеризуется набором макроскопических параметров, которые описывают систему в целом. Одним из таких параметров и является температура.
Приборы для измерения влажности
Приборы, с помощью которых можно измерять влажность, называют гигрометрами. Есть несколько типов таких приборов: волосные, конденсационные, психрометрические.
Волосной гигрометр
В волосном гигрометре используют свойство волоса изменять свою длину при изменении влажности. Чем больше влажность воздуха, тем длиннее становится волос. Обычно используют волосок из конской гривы, либо длинный человеческий волос. Один конец волоса закреплен на корпусе прибора, а другой прикрепляется к стрелке (рис. 1). По шкале прибора можно определить относительную влажность воздуха.
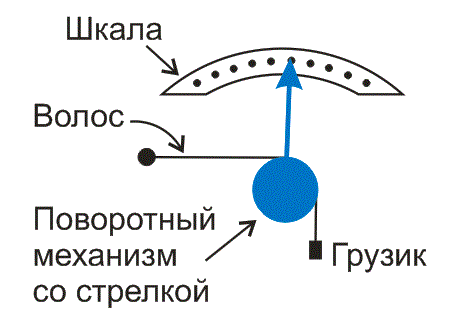 Рис. 1. Волосной гигрометр состоит из шкалы, поворотного механизма со стрелкой и волоса
Рис. 1. Волосной гигрометр состоит из шкалы, поворотного механизма со стрелкой и волоса
Конденсационный гигрометр
Конденсационный гигрометр по точке росы помогает определить абсолютную влажность воздуха.
Сначала определяют точку росы с помощью встроенного в прибор термометра. Затем, по таблице, содержащей плотность и парциальное давление водяного пара при различных температурах, определяют абсолютную влажность воздуха.
При известной температуре воздуха и абсолютной влажности можно дополнительно вычислить относительную влажность воздуха.
Устройство конденсационного гигрометра представлено на рисунке 2.
В небольшую металлическую коробку, встроена трубка с грушей и термометр. Передняя тонкая стенка коробки отполирована, чтобы на ней удобнее было наблюдать конденсацию капелек воды. Металлическое кольцо, придающее жесткость тонкой передней стенке, прикреплено через прокладку для теплоизоляции.
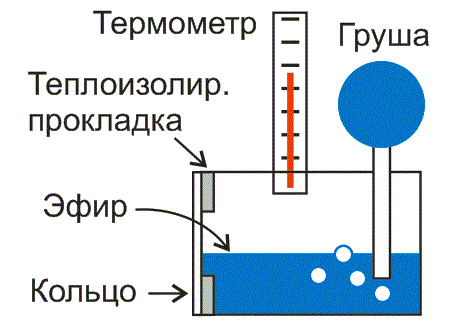 Рис. 2. Конденсационный гигрометр содержит термометр и грушу, погруженные в емкость с быстро испаряющейся жидкостью, емкость имеет полированную стенку, на которой может конденсироваться вода из воздуха
Рис. 2. Конденсационный гигрометр содержит термометр и грушу, погруженные в емкость с быстро испаряющейся жидкостью, емкость имеет полированную стенку, на которой может конденсироваться вода из воздуха
Используют прибор так: Наливают в коробку быстро испаряющуюся жидкость (спирт, эфир и т. п.), и продувают грушей воздух через коробку. Тем самым, вызывают быстрое испарение жидкости и понижение температуры в коробке. При этом на полированной передней стенке коробки появляется роса. А термометр позволяет измерить температуру, при которой роса конденсировалась. Появление росы говорит о том, что пар стал насыщенным.
Абсолютную влажность воздуха определяют по таблице, в которой содержится плотность и парциальное давление водяного пара при различных температурах.
Психрометрический гигрометр
Такой прибор для измерения относительной влажности сокращенно называют психрометром. Он состоит из двух одинаковых термометров, закрепленных на держателе (рис. 3). Нижняя часть одного из термометров погружена в небольшую емкость, содержащую несколько миллилитров воды. Обычно на корпус этого прибора наносят психрометрическую таблицу. Благодаря этой таблице, считав показания двух термометров, можно определить относительную влажность воздуха.
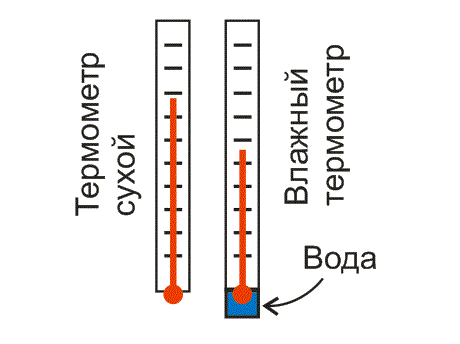 Рис. 3. Психрометрический гигрометр состоит из сухого и влажного термометров
Рис. 3. Психрометрический гигрометр состоит из сухого и влажного термометров
Самодельный психрометр
Чтобы изготовить самодельный психрометр, нужно взять два одинаковых бытовых спиртовых термометра.
В нижней части каждого термометра присутствует шарик с жидкостью. Эта жидкость расширяется при возрастании температуры. Излишки жидкости из шарика поднимаются по тонкой трубке, рядом с которой нанесены деления температурной шкалы. Обычно в качестве такой жидкости используют подкрашенный спирт (спиртовой термометр), или ртуть (ртутный термометр).
Шарик одного из термометров нужно обернуть кусочком ваты, или небольшой тряпочкой, смоченной водой комнатной температуры. Этот термометр договоримся называть «влажным».
Со вторым термометром ничего делать не нужно. Этот термометр будем называть «сухим».
Расположим эти термометры неподалеку один от другого. Спустя несколько минут самодельный психрометр будет готов к измерениям влажности.
Нам известно, что температура жидкости уменьшается при испарении (ссылка). Поэтому, показания влажного термометра всегда будут меньше показаний сухого термометра. Чем суше воздух, тем больше будет разница между показаниями термометров. Потому, что в сухом воздухе скорость испарения (ссылка) воды возрастает.
Запишем показания сухого и влажного термометров. Относительную влажность воздуха можно найти с помощью психрометрической таблицы.
Отрицательные температуры
Физики утверждают, что бывают даже отрицательные температуры по Кельвину (или Ранкину). Однако это не означает, что частицы становятся холоднее абсолютного нуля. Скорее это показатель того, что просто уменьшилась их энергия.
Это происходит по той причине, что температура является термодинамической величиной. Она связывает между собой энергию и энтропию. Когда система приближается к своей минимальной энергии, ее энтропия начинает увеличиваться. Это происходит только при особых обстоятельствах. Например, в квазиравновесных состояниях. Однако такая активность может привести к возникновению отрицательной температуры. Даже если энергия системы начнет увеличиваться.
Это может показаться странным, но система с отрицательной температурой может быть более горячей, чем система с положительной температурой. Так происходит потому, что распределение тепловой энергии может иметь разное направление. Обычно, в мире с положительной температурой, тепло течет из более горячего места, такого как нагретая печь, в более прохладное место, такое как комната. В системе с отрицательными температурами все будет происходить наоборот.
3 января 2013 года ученые сумели получить квантовый газ, состоящий из атомов калия, который имел отрицательную температуру. Еще ранее, в 2011 году, Вольфганг Кеттерле, Патрик Медли и их команда продемонстрировали возможность получения отрицательной абсолютной температуры в магнитной системе.