Удельное тепло для идеального газа при стабильных объеме и давлении
Содержание:
AISI 304
Обозначение по международным стандартам
| Температура, ºC | Сталь 20 | Сталь 40 | Температура, ºC | Сталь 20 | Сталь 40 |
| 50 – 100 | 486 | 486 | 700 – 750 | 1433 | 1584 |
| 100 – 150 | 507 | 503 | 750 – 800 | 951 | 624 |
| 150 – 200 | 520 | 515 | 800 – 850 | 737 | 503 |
| 200 – 250 | 532 | 528 | 850 – 900 | 649 | 549 |
| 250 – 300 | 557 | 549 | 900 – 950 | 649 | 624 |
| 300 – 350 | 574 | 570 | 950 – 1000 | 649 | 624 |
| 350 – 400 | 599 | 587 | 1000 – 1050 | 649 | 633 |
| 400 – 450 | 624 | 612 | 1050 – 1100 | 649 | 633 |
| 450 – 500 | 662 | 649 | 1100 – 1150 | 658 | 641 |
| 500 – 550 | 704 | 691 | 1150 – 1200 | 666 | 654 |
| 550 – 600 | 750 | 708 | 1200 – 1250 | 679 | 670 |
| 600 – 650 | 788 | 733 | 1250 – 1300 | 687 | 687 |
| 650 – 700 | 846 | 771 | |||
| Температура, ºC | Сталь 20 | Сталь 40 | Температура, ºC | Сталь 20 | Сталь 40 |
| 100 | 486 | 486 | 750 | 679 | 670 |
| 150 | 494 | 494 | 800 | 675 | 704 |
| 200 | 499 | 503 | 850 | 662 | 704 |
| 250 | 507 | 511 | 900 | 658 | 704 |
| 300 | 515 | 520 | 950 | 654 | 700 |
| 350 | 524 | 528 | 1000 | 654 | 696 |
| 400 | 532 | 541 | 1050 | 654 | 691 |
| 450 | 545 | 549 | 1100 | 649 | 691 |
| 500 | 557 | 561 | 1150 | 649 | 691 |
| 550 | 570 | 574 | 1200 | 649 | 687 |
| 600 | 582 | 591 | 1250 | 654 | 687 |
| 650 | 595 | 608 | 1300 | 654 | 687 |
| 700 | 608 | 629 |
| Международный стандарт | Американский ASTM A240 | Европейский ЕN 10088-2 | Российский ГОСТ 5632-72 |
| Обозначение марки | AISI 304 | 1.4301 | 08Х18Н10 |
| 12Х18Н9 |
Применяемые стандарты и одобрения
AMS 5513 ASTM A 240 ASTM A 666
Применение
- Предметы домашнего обихода
- Раковины
- Каркасы для металлоконструкций в строительной промышленности
- Кухонная утварь и оборудование для общепита
- Молочное оборудование, пивоварение
- Сварные конструкции
- Резервуары судовые и наземные танкеры для продовольствия, напитков и некоторых химических веществ
Обычно производители стали разделяют марку на три основных класса (сорта) по способности к волочению:
- AISI 304 – Основной сорт
- AISI 304 DDQ (Normal and deep drawing) – Сорт глубокой вытяжки
- AISI 304 DDS (Extra deep drawing) – Сорт особо глубокой вытяжки
Механические свойства
| AISI 304 | Сопротивление на разрыв (σв), Н/мм² | Предел текучести(σ0,2), Н/мм² | Предел текучести(σ1,0), Н/мм² | Относительное удлинение (σ), % | Твердость по Бринеллю (HB) | Твердость по Роквеллу (HRB) |
| В соответствии с EN 10088-2 | ≥520 | ≥210 | ≥250 | ≥45 | – | – |
| В соответствии с ASTM A 240 | ≥515 | ≥205 | – | ≥40 | 202 | 85 |
Механические свойства при высоких температурах
Все эти значения относятся к только AISI 304
Физические свойства
| Физические свойства | Условные обозначения | Единица измерения | Температура | Значение |
| Плотность | d | – | 4°C | 7.93 |
| Температура плавления | °C | 1450 | ||
| Удельная теплоемкость | c | J/kg.K | 20°C | 500 |
| Тепловое расширение | k | W/m.K | 20°C | 15 |
| Средний коэффициент теплового расширения | α | 10 -6 .K -1 | 0-100°C 0-200°C | 17.5 18 |
| Электрическое удельное сопротивление | ρ | Ωmm 2 /m | 20°C | 0.80 |
| Магнитная проницаемость | μ | в 0.80 kA/m DC или в/ч AC | 20°C μ μ разряж.возд. | 1.02 |
| Модуль упругости | E | MPa x 10 3 | 20°C | 200 |
Сопротивление коррозии
304-е стали имеют хорошее сопротивление к общим коррозийным средам, но не рекомендованы там, где есть риск межкристаллитной коррозии. Они хорошо приспособлены для эксплуатации в пресной воде и городской и сельской среде. Во всех случаях необходима регулярная очистка внешних поверхностей для сохранения их первоначального состояния.
304-е стали имеют хорошее сопротивление различным кислотам:
- фосфорной кислоте во всех концентрациях при температуре окружающей среды,
- азотной кислоте до 65 % при температуре 20°C – 50°C,
- муравьиной и молочной кислоте при комнатной температуре,
- уксусной кислоте при температуре 20°C – 50°C.
Их рекомендуют для производства оборудования, контактирующего с холодными или горячими пищевыми продуктами: вино, пиво, молоко (кисломолочные продукты), спирт, натуральные плодовые соки, сиропы, патока, и т.д.
Кислотные среды
| Температура, °C | 20 | 80 | ||||||||||
| Концентрация, % к массе | 10 | 20 | 40 | 60 | 80 | 100 | 10 | 20 | 40 | 60 | 80 | 100 |
| Серная кислота | 2 | 2 | 2 | 2 | 1 | 2 | 2 | 2 | 2 | 2 | 2 | |
| Азотная кислота | 2 | 1 | 2 | |||||||||
| Фосфорная кислота | 2 | 1 | 2 | |||||||||
| Муравьиная кислота | 1 | 2 | 2 | 1 |
Код: 0 = высокая степень защиты – Скорость коррозии менее чем 100мкм/год 1 = частичная защита – Скорость коррозии от 100 до 1000мкм/год 2 = нет защиты – Скорость коррозии более чем 1000мкм/год
Атмосферные воздействия
Сравнение 304-й
марки с другими металлами в различных окружающих средах (Скорость коррозии расчитана при 10-летнем воздействии).
| Окружающая среда | Скорость коррозии (мкм/год) | ||
| AISI 304 | Алюминий-3S | Углеродистая сталь | |
| Сельская | 0.0025 | 0.025 | 5.8 |
| Морская | 0.0076 | 0.432 | 34.0 |
| Индустриальная Морская | 0.0076 | 0.686 | 46.2 |
Устойчивость к коррозии в кипящих химикалиях
| Кипящая среда | Состояние металла | Скорость коррозии (мм/год) |
| 20%-ая уксусная кислота | Обычный металл Сваренный | * (При толщине образца 0.8 мм и диаметре пресса равном 20 мм) |
| AISI 430 | 2.05 мм | |
| AISI 304 | 2.0 мм |
*Limiting drawing ratio – предельный коэффициент вытяжки
Краткая теория и методика выполнения работы
Удельной
теплоемкостью
вещества называется величина, равная
количеству теплоты, которую необходимо
сообщить единице массы вещества для
увеличения ее температуры на один градус
Кельвина:
. (4.1)
Теплоемкость
одного моля вещества называется молярной
теплоемкостью:
, (4.2)
где
m – масса, µ – молярная масса вещества,– число молей газа.
Значение
теплоемкости газов зависит от условий
их нагревания. В соответствии с первым
законом термодинамики количество
теплоты,
сообщенное системе, расходуется на
увеличение ее внутренней энергиии на совершение системой работыпротив внешних сил:
. (4.3)
Изменение
внутренней энергии идеального газа в
случае изменения его температурыравно:
, (4.4)
здесь
– число степеней свободы молекулы газа,
под которым подразумевается число
независимых координат, полностью
определяющих положение молекулы в
пространстве;– универсальная газовая постоянная.
При
расширении газа система совершает
работу:
. (4.5)
Если
газ нагревать при постоянном объеме
(),
тои, согласно (4.3), все полученное газом
количество теплоты расходуется только
на увеличение его внутренней энергии.
Следовательно, учитывая (4.4), молярная
теплоемкость идеального газа при
постоянном объеме будет равна:
. (4.6)
Если
газ нагревать при постоянном давление
(),
то полученное газом количество теплоты
расходуется на увеличение его внутренней
энергиии совершение газом работы:
.
Тогда
молярная теплоемкость идеального газа
при постоянном давлении определяется
следующим образом:
. (4.7)
Используя
уравнение состояния идеального газа
(уравнение Клапейрона–Менделеева),
можно показать, что для одного моля газа
справедливо соотношение:
,
поэтому:
.
Последнее выражение
называют уравнением Майера. Из него,
учитывая (4.6), получаем:
. (4.8)
Отношение
теплоемкостейобозначаюти называют показателем адиабаты или
коэффициентом Пуассона:
. (4.9)
Адиабатным
называется процесс, протекающий в
термоизолированной системе, т.е. без
теплообмена с окружающей средой,.
На
практике он может быть осуществлен в
системе, окруженной теплоизоляционной
оболочкой, но поскольку для теплообмена
необходимо некоторое время, то адиабатным
можно считать также процесс, который
протекает так быстро, что система не
успевает вступить в теплообмен с
окружающей средой.
Первый
закон термодинамики для адиабатного
процесса имеет вид.
Знак минус говорит о том, что при
адиабатном процессе система может
совершать работу только за счет внутренней
энергии. С учетом (4.4)–(4.6) имеем:
. (4.10)
Продифференцировав
уравнение Клапейрона–Менделеева,
получим:
.
Выразим
из негои подставим в формулу (4.10):
.
Выразивиз уравнения Майера и учитывая соотношение
(4.8), получим:
.
Интегрируя
данное дифференциальное уравнение при
условииполучим выражение:
.
(4.11)
Уравнение
(4.11) называется уравнением адиабаты или
уравнением Пуассона.
Метод
определения показателя адиабаты,
предложенный Клеманом и Дезормом (1819
г.), основывается на изучении параметров
некоторой массы газа, переходящей из
одного состояния в другое двумя
последовательными процессами –
адиабатным и изохорным. Эти процессы
на диаграмме–(рис. 4.1) изображены кривыми соответственно
1–2 и 2–3.
Если
в сосуд, соединенный с дифференциальным
датчиком давления, накачать воздух и
подождать до установления теплового
равновесия с окружающей средой, то в
этом начальном состоянии 1 газ имеет
параметры,,,
причем температура газа в сосуде равна
температуре окружающей среды,
а давлениенемного больше атмосферного.
Если
теперь на короткое время соединить
сосуд с атмосферой, то произойдет
адиабатное расширение воздуха. При этом
воздух в сосуде перейдет в состояние
2, его давление понизится до атмосферного.
Масса воздуха, оставшегося в сосуде,
которая в состоянии 1 занимала часть
объема сосуда, расширяясь, займет весь
объем.
При этом температура воздуха, оставшегося
в сосуде, понизится до.
Поскольку процесс 1–2 – адиабатный, к
нему можно применить уравнение Пуассона
(4.11):
или.
Отсюда:
. (4.12)
После
кратковременного соединения сосуда с
атмосферой охлажденный из-за адиабатного
расширения воздух в сосуде будет
нагреваться (процесс 2–3) до температуры
окружающей средыпри постоянном объеме.
При этом давление в сосуде поднимется
до.
Поскольку
процесс 2–3 – изохорный, к нему можно
применить закон Шарля:
или
. (4.13)
Из уравнений (4.12)
и (4.13) получим:
.
Прологарифмируем
это выражение:
.
Поскольку
избыточные давленияиочень малы по сравнению с атмосферным
давлением,
а также учитывая, что при,
будем иметь:
.
Откуда:
. (4.14)
Избыточные
давленияиизмеряют с помощью дифференциального
датчика давления.
2.2.5 Опасные свойства природного газа
Токсичность
С увеличением молекулярной массы предельных углеводородов
их токсические свойства возрастают. Санитарными нормами проектирования
промышленных предприятий предусмотрена в рабочей зоне производственных
помещений предельно допустимая концентрация углеводородов (паров бензина),
равная 0,3 мг/дм3. Из газовых компонентов природных и нефтяных газов особенно
токсичен сероводород. Сероводород
— бесцветный газ.
Относительная плотность его по воздуху 1,19. Человек чувствует сероводород
(запах тухлых яиц) даже при содержании его в воздухе 0,0014—0,0023 мг/дм3.
Однако даже при непродолжительном пребывании человека в сероводородной среде
его обоняние притупляется. Сероводород является ядом, вызывающим паралич
органов дыхания и сердца. Предельно допустимая концентрация сероводорода в
рабочей зоне производственных помещений —0,01 мг/дм3. Углекислый газ —
бесцветный, практически без запаха. Общий характер действия на организм —
наркотический и раздражающий кожу и слизистые оболочки. В высоких концентрациях
вызывает быстрое удушье вследствие недостатка кислорода. При содержании 4—5%
углекислого газа в воздухе у человека раздражается слизистая оболочка
дыхательных путей и глаз, появляются кашель, головокружение, повышается кровяное
давление. При вдыхании весьма высоких концентраций углекислого газа наступает
смерть от остановки дыхания (при 20% газа в воздухе смерть наступает через
несколько секунд).
Способность к образованию взрывоопасных смесей
Природные углеводородные газы образуют взрывоопасные
смеси с воздухом.Для
каждых данных условий существуют два предела взрываемости газовоздушных смесей:
1)нижний предел соответствует минимальной концентрации
горючего газа, при которой горение еще возможно;
2)верхний предел соответствует максимуму этой
концентрации.
С повышением давления смеси значительно возрастают пределы
ее взрываемости. Горение и взрыв — однотипные химические процессы, но резко
отличающиеся по интенсивности протекающей реакции. При взрыве реакция
происходит очень быстро в замкнутом пространстве без доступа воздуха к очагу
воспламенения взрывоопасной газовоздушной смеси. Скорость распространения
детонационной волны горения при взрыве (900—3000 м/с) в несколько раз превышает
скорость звука в воздухе при комнатной температуре. Сила взрыва максимальна,
когда содержание воздуха в смеси становится теоретически необходимым для
полного сгорания. При концентрации газа в воздухе в пределах воспламенения и
при наличии источника воспламенения произойдет взрыв; еслижесодержаниегазаввоздухеменьшенижнегоибольше верхнего пределоввоспламенения, то смесьне способнавзорваться.
Изопроцессы в газах
Определение 2
Чаще всего рассматриваются два значения теплоемкости газов:
- CV являющаяся молярной теплоемкостью в изохорном процессе (V=const);
- Cp представляющая собой молярную теплоемкость в изобарном процессе (p=const).
При условии постоянного объема газ не совершает работы: A=. Исходя из первого закона термодинамики для 1 моля газа, можно сказать, что справедливым является следующее выражение:
QV=CV∆T=∆U.
Изменение величины ΔU внутренней энергии газа прямо пропорционально изменению значения ΔT его температуры.
В условиях процесса при постоянном давлении первый закон термодинамики дает такую формулу:
Qp=∆U+p(V2-V1)=CV∆T+pV.
В котором ΔV является изменением объема 1 моля идеального газа при изменении его температуры на ΔT. Таким образом, можно заявить, что:
Cp=Qp∆T=CV+p∆V∆T.
Из уравнения состояния идеального газа, записанного для 1 моля, может выражаться отношение ΔVΔT:
pV=R.
В котором R представляет собой универсальную газовую постоянную. При условии постоянства давления p=const, можно записать следующее:p∆V=R∆T или ∆V∆T=Rp.
Определение 3
Из этого следует, что выражающее связь между молярными теплоемкостями Cp и CVсоотношение имеет вид (формула Майера):
Cp=CV+R.
В процессе с неизменным давлением молярная теплоемкость Cp газа всегда превышает молярную теплоемкость CV в процессе с не подверженным изменениям объемом, что демонстрируется на рисунке 3.10.1.
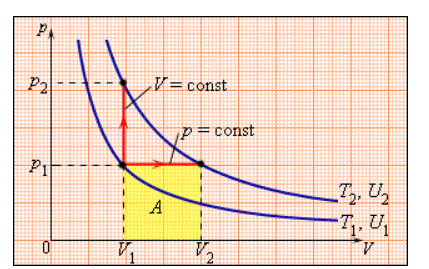
Рисунок 3.10.1. Два возможных процесса нагревания газа на ΔT=T2 –T1. При p=const газ совершает работу A=p1(V2 – V1). Поэтому Cp>CV.
Определение 4
Отношение теплоемкостей в процессах с постоянным давлением и постоянным объемом занимает важное место в термодинамике и обозначается в виде греческой буквы γ.
γ=CpCV.
Данное отношение включено в формулу для адиабатического процесса.
Между двумя изотермами, обладающими температурами T1 и T2 на диаграмме (p, V) реальны различные варианты перехода. Так как для всех подобных переходов изменение величины температуры ΔT=T2 –T1 является одним и тем же, выходит, что изменение значенияΔU внутренней энергии тоже одинаково. С другой стороны, совершенные при этом работы A и количества теплоты Q, полученные в результате теплообмена, выйдут разными для различных путей перехода. Из этого следует, что газа имеет относительно приближенное к бесконечности число теплоемкостей. Cp и CV представляют собой частные, однако, очень важные для теории газов, значения теплоемкостей.
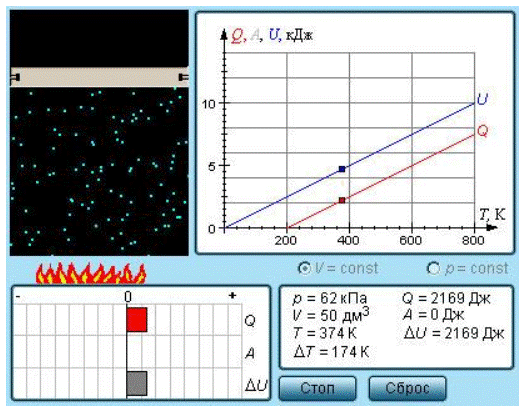
Рисунок 3.10.2. Модель теплоемкости идеального газа.
Определение 5
Термодинамические процессы, в которых теплоемкость газа не подвергается изменениям, носят название политропических.
Нужна помощь преподавателя?
Опиши задание — и наши эксперты тебе помогут!
Описать задание
Каждый изопроцесс являются политропическим. В изотермическом процессе ΔT=, из-за чего CT=∞. В адиабатическом процессе ΔQ=, выходит, что Cад=.
Замечание 1
Стоит обратить внимание на то, что «теплоемкость» и «количество теплоты» являются крайне неудачными терминами, доставшимися современной науке в качестве наследства теории теплорода, которая господствовала в XVIII веке. Данная теория представляла теплоту в виде содержащегося в телах особого невесомого вещества
Считалось, что оно не подвержено уничтожению и не может быть созданным. Явление нагрева объясняли повышением, а охлаждение – понижением содержания в телах теплорода. Однако теория теплорода оказалась несостоятельной, так как не смогла дать ответа на вопрос, почему одинаковое изменение внутренней энергии тела возможно получить, приводя ему разное количество теплоты в зависимости от совершаемой им работы. По этой причине утверждение, что в данном теле содержится некоторый запас теплорода лишено смысла
Данная теория представляла теплоту в виде содержащегося в телах особого невесомого вещества. Считалось, что оно не подвержено уничтожению и не может быть созданным. Явление нагрева объясняли повышением, а охлаждение – понижением содержания в телах теплорода. Однако теория теплорода оказалась несостоятельной, так как не смогла дать ответа на вопрос, почему одинаковое изменение внутренней энергии тела возможно получить, приводя ему разное количество теплоты в зависимости от совершаемой им работы. По этой причине утверждение, что в данном теле содержится некоторый запас теплорода лишено смысла.
Определение
Удельная теплоемкость вещества, обычно обозначаемая как c{ displaystyle c}, — теплоемкость C{ displaystyle C} образца вещества, деленного на массу M{ displaystyle M} образца:
- c=CM=1M⋅dQdТ{ displaystyle c = { frac {C} {M}} = { frac {1} {M}} cdot { frac { mathrm {d} Q} { mathrm {d} T}}}
куда dQ{ displaystyle mathrm {d} Q} представляет количество тепла, необходимое для равномерного повышения температуры образца с небольшим шагом dТ{ displaystyle mathrm {d} T}.
Как и теплоемкость объекта, удельная теплоемкость вещества может варьироваться, иногда существенно, в зависимости от начальной температуры. Т{ displaystyle T} образца и давление п{ displaystyle p} применяется к нему. Следовательно, ее следует рассматривать как функцию c(п,Т){ displaystyle c (p, T)} этих двух переменных.
Эти параметры обычно указываются при указании удельной теплоемкости вещества. Например, «Вода (жидкость): cп{ displaystyle c_ {p}} = 4185,5 Дж / К / кг (15 ° C, 101,325 кПа) » Если не указано иное, опубликованные значения удельной теплоемкости c{ displaystyle c} как правило, действительны для некоторых стандартные условия по температуре и давлению.
Однако зависимость c{ displaystyle c} на начальную температуру и давление часто можно игнорировать в практических контекстах, например при работе в узких диапазонах этих переменных. В этих контекстах обычно опускают квалификатор (п,Т){ displaystyle (p, T)}, и аппроксимирует теплоемкость константой c{ displaystyle c} подходит для этих диапазонов.
Удельная теплоемкость — это интенсивное свойство вещества, внутренняя характеристика, которая не зависит от размера или формы рассматриваемого количества. (Квалификатор «специфический» перед экстенсивным свойством часто указывает на интенсивное свойство, производное от него.)
Вариации
Введение тепловой энергии в вещество, помимо повышения его температуры, обычно вызывает увеличение его объема и / или давления, в зависимости от того, как удерживается образец. Выбор последнего влияет на измеренную удельную теплоемкость даже при том же начальном давлении. п{ displaystyle p} и начальная температура Т{ displaystyle T}. Широко используются два конкретных варианта:
- Если давление поддерживается постоянным (например, при атмосферном давлении окружающей среды), а образец расширяется, расширение вызывает работай поскольку сила давления смещает корпус или окружающую жидкость. Эта работа должна производиться за счет поставляемой тепловой энергии. Полученная таким образом удельная теплоемкость называется измеренной. при постоянном давлении (или же изобарический), и часто обозначается cп{ displaystyle c_ {p}}, cп{ displaystyle c _ { mathrm {p}}}, так далее.
- С другой стороны, если расширение предотвращается — например, за счет достаточно жесткого корпуса или увеличения внешнего давления, чтобы противодействовать внутреннему, — работа не создается, и тепловая энергия, которая пошла бы в него, должна вместо этого способствовать внутренняя энергия образца, в том числе повышение его температуры на дополнительную величину. Полученная таким образом удельная теплоемкость называется измеренной. при постоянной громкости (или же изохорный) и обозначили cV{ displaystyle c_ {V}}, cv{ displaystyle c_ {v}} cv{ displaystyle c _ { mathrm {v}}}, так далее.
Значение cV{ displaystyle c_ {V}} обычно меньше, чем значение cп{ displaystyle c_ {p}}. Эта разница особенно заметна для газов, где значения при постоянном давлении обычно на 30–66,7% больше, чем при постоянном объеме. Следовательно коэффициент теплоемкости газов обычно составляет от 1,3 до 1,67.
Применимость
Удельную теплоемкость можно определить и измерить для газов, жидкостей и твердых тел довольно общего состава и молекулярной структуры. К ним относятся газовые смеси, растворы и сплавы или гетерогенные материалы, такие как молоко, песок, гранит и бетон, если рассматривать их в достаточно большом масштабе.
Удельная теплоемкость также может быть определена для материалов, которые изменяют состояние или состав при изменении температуры и давления, если изменения обратимы и постепенны. Таким образом, например, концепции могут быть определены для газа или жидкости, которые диссоциируют при повышении температуры, до тех пор, пока продукты диссоциации быстро и полностью рекомбинируют при падении.
Удельная теплоемкость не имеет значения, если вещество претерпевает необратимые химические изменения или если есть изменение фазы, например, плавление или кипение при резкой температуре в диапазоне температур, охватываемых измерением.
Теплоотдача и терморегуляция
Количество
теплоты Q,
переносимое вследствие теплопроводности
за время Δt,
определяется формулой
Q=k1ΔTΔSΔt/Δx
где
k1—
коэффициент теплопроводности; ΔT/Δx
— градиент тем-
пературы
в направлении, перпендикулярном площадке
ΔS.
Количество
теплоты Q,
переносимое вследствие конвекции за
время Δt,
определяется формулой;
Q=k2(T-T)ΔSΔt
где
k2
— коэффициент теплопередачи при
конвекции; Т и Т
— соответственно
температуры поверхности ΔS
и омываемой среды.
Количество
теплоты Q,
излучаемое за время Δt
абсолютно черным телом, определяется
формулой (закон Стефана — Больцмана)
Q=σT4ΔSΔt
где
σ—
постоянная Стефана — Больцмана; Т
— абсолютная температура
тела; ΔS
— площадь излучающей поверхности тела.
Для
реальных физических тел закон Стефана
— Больцмана имеет
вид
Q=k3σT4ΔSΔt
где
k3
— коэффициент, учитывающий, что свойства
поверхности реальных
физических тел отличны от свойств
поверхности абсолютно
черного тела (k3<. k>3=
1.
При
наличии двух встречных потоков радиации
от излучающей
поверхности к среде и от среды к
поверхности закон Стефана
— Больцмана имеет вид
Q=k3σ(T4–T4)ΔSΔt
где
Т и Т
— абсолютные температуры тела и
среды; ΔS
— площадь
излучающей поверхности тела.
Длина
волны λт,
которой соответствует максимум
излуча-тельной способности черного
тела, обратно пропорциональна абсолютной
температуре Т (закон смещения Вина):
λm=b/T
где
b
— постоянная закона смещения Вина.
2.2.4 Тепловые свойства природных газов
Теплоемкость природного газа
Удельной теплоемкостью называется количество
теплоты, которое необходимо подвести к единице массы вещества, чтобы изменить
его температуру на 1 градус.
Для
газов различают удельные теплоемкости: изобарную ср (р=const) и
изохорную сv (v=const)
Изобарная молярная теплоемкость природных
газов определяется по формуле:
ср=0,523(8,36+0,00892t)Мi3/4, (2.10)
где t-температура, °С;Мi-молекулярная масса I-го компонента природного газа.
Тогда
для смеси газов формула (17) преобразуется следующим образом:
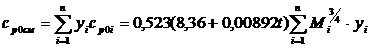 ,(2.11)
,(2.11)
где yi-молярная
доля I-го компонента в смеси, срi-изобарная молярная
теплоемкость I-го компонента.
Изобарная молярная теплоемкость реальных природных
газов зависит от давления и от температуры ср=ср(t)+Dcp(P,t),(2.12)
где Dcp(P,t)-изотермическая
поправка теплоемкости на давление, ее можно определить по номограмме в зависимости
от приведенных параметров.
Для
приближенных расчетов при 0,02≤Рпр≤4, 1,3≤Тпр≤2,5
Dc=32,600Рпр/Тпр4
кДж/(кмоль∙К)(2.13)
Теплоемкость неуглеводородных компонентов (N2, H2S и СО2) примерно
равна 0,5 теплоемкости углеводорода с одинаковой молярной массой.
Теплотоворная способность или теплота сгорания – количество тепла, выделяемое при сгорании при
определенных условиях (чаще всего при Р=0,013 МПа и Т=288К).
Единицы измерения- МДж/кг, МДж/м3 (ккал/кг, ккал/м3). Различают
высшую и низшую теплоту сгорания. Для получения низшей теплоты сгорания из
высшей вычитают тепло, расходуемое на испарение гигроскопической воды.
Присутствие в смесиинертных газов
понижает теплоту сгорания. При сгорании 1кг каменного угля выделяется 9
ккал,1кг нефти – 11 ккал, 1м3 газа
— 7 ккал.
Дросселирование–
расширение газа при прохождении через дроссель — местноегидравлическое сопротивление (вентиль, кран,
сужение трубопровода и т.д.), сопровождающееся изменением температуры.
Дросселирование – термодинамический процесс, характеризующийся постоянством
энтальпии (i = const).В процессе дросселирования реального
природного газа при его движении через штуцер, задвижку, регулятор давления,
клапан-отсекатель, колонны труб в скважине, неплотности в оборудовании
промыслов уменьшается температура газа.
Изменение температуры газов и жидкостей
при изоэнтальпийном расширении называется эффектом Джоуля-Томсона или дроссель-эффектом, а Diчастоназывают коэффициентом Джоуля-Томсона.
Di = (¶Т¶р)i= [T
(¶V¶Т)p –V]/сp, илиDi= DТDР,
(2.14)
где DТ – изменение температуры, а DР- изменение давления. Среднее
значение коэффициента Джоуля—Томсона для природного газа изменяется от 2 до 4 К/МПа в зависимости от составагаза, падения
давления и начальной температуры газа. Для приближенных расчетов среднее
значение коэффициента Джоуля—Томсона можно принимать равным 3
К/МПа.У жидкостей Di, <;0, поэтому при дросселировании они нагреваются.
Для наибольшего снижения температуры газа в штуцере необходимо удалять жидкость
из газового потока до его поступления в штуцер.Среднее
значение коэффициента Джоуля—Томсона для нефти изменяется от 0,4 до 0,6 К/МПа,
для воды оно составляет 0,235 К/МПа.
Таблица удельной теплоемкости пищевых продуктов
В таблице приведены значения средней удельной теплоемкости пищевых продуктов (овощей, фруктов, мяса, рыбы, хлеба, вина и т. д.) в диапазоне температуры 5…20°С и нормальном атмосферном давлении.
| Продукты | C, Дж/(кг·К) |
|---|---|
| Абрикосы | 3770 |
| Ананасы | 3684 |
| Апельсины | 3730 |
| Арбуз | 3940 |
| Баклажаны | 3935 |
| Брюква | 3810 |
| Ветчина | 2140 |
| Вино крепленое | 3690 |
| Вино сухое | 3750 |
| Виноград | 3550 |
| Вишня | 3650 |
| Говядина и баранина жирная | 2930 |
| Говядина и баранина маложирная | 3520 |
| Горох | 3684 |
| Грибы свежие | 3894 |
| Груши | 3680 |
| Дрожжи прессованные | 1550…3516 |
| Дыни | 3850 |
| Ежевика | 3642 |
| Земляника | 3684 |
| Зерно пшеничное | 1465…1549 |
| Кабачки | 3900 |
| Капуста | 3940 |
| Картофель | 3430 |
| Клубника | 3810 |
| Колбасы | 1930…2810 |
| Крыжовник | 3890 |
| Лимоны | 3726 |
| Лук | 2638 |
| Макароны не приготовленные | 1662 |
| Малина | 3480 |
| Мандарины | 3770 |
| Маргарин сливочный | 2140…3182 |
| Масло анисовое | 1846 |
| Масло мятное | 2080 |
| Масло сливочное | 2890…3100 |
| Масло сливочное топленое | 2180 |
| Мед | 2300…2428 |
| Молоко сухое | 1715…2090 |
| Морковь | 3140 |
| Мороженое (при -10С) | 2175 |
| Мука | 1720 |
| Огурцы | 4060 |
| Пастила | 2090 |
| Патока | 2512…2700 |
| Перец сладкий | 3935 |
| Печенье | 2170 |
| Помидоры | 3980 |
| Пряники | 1800…1930 |
| Редис | 3970 |
| Рыба жирная | 2930 |
| Рыба нежирная | 3520 |
| Салат зеленый | 4061 |
| Сало топленое | 2510 |
| Сахар кусковой | 1340 |
| Сахарный песок | 720 |
| Свекла | 3340 |
| Свинина жирная | 260 |
| Свинина нежирная | 3010 |
| Слива | 3750 |
| Сметана | 3010 |
| Смородина черная | 3740 |
| Сода | 2256 |
| Соль поваренная (2% влажности) | 920 |
| Спаржа | 3935 |
| Сыр жирный | 2430 |
| Творог | 3180 |
| Телятина жирная | 3180 |
| Телятина нежирная | 3520 |
| Тесто заварное | 2910 |
| Тыква | 3977 |
| Хлеб (корка) | 1680 |
| Хлеб (мякиш) | 2800 |
| Черешня | 3770 |
| Чернослив | 3181 |
| Чеснок | 3140 |
| Шоколад | 2340…2970 |
| Шпинат | 3977 |
| Яблоки | 3760 |
| Яйцо куриное | 3180 |
Кроме таблиц удельной теплоемкости, вы также можете ознакомиться с подробнейшей таблицей плотности веществ и материалов, которая содержит данные по величине плотности более 500 веществ (металлов, пластика, резины, продуктов, стекла и др.).
- Исаченко В. П., Осипова В. А., Сукомел А. С. Теплопередача. Учебник для вузов, изд. 3-е, перераб. и доп. — М.: «Энергия», 1975.
- Тепловые свойства металлов и сплавов. Справочник. Лариков Л. Н., Юрченко Ю. Ф. — Киев: Наукова думка, 1985. — 439 с.
- Физические величины. Справочник. А. П. Бабичев, Н. А. Бабушкина, А. М. Братковский и др. Под ред. И. С. Григорьева — М.: Энергоатомиздат, 1991. — 1232 с.
- Еремкин А. И., Королева Т. И. Тепловой режим зданий: Учебное пособие. — М.: Издательство ACB, 2000 — 368 с.
- Кириллов П. Л., Богословская Г. П. Тепломассобмен в ядерных энергетических установках: Учебник для вузов.
- Михеев М. А., Михеева И. М. Основы теплопередачи. Изд. 2-е, стереотип. М.: «Энергия», 1977. — 344 с. с ил.
- Казанцев Е. И. Промышленные печи. Справочное руководство для расчетов и проектирования.
- Франчук А. У. Таблицы теплотехнических показателей строительных материалов, М.: НИИ строительной физики, 1969 — 142 с.
- Добрынин В. М., Вендельштейн Б. Ю., Кожевников Д. А. Петрофизика: Учеб. для вузов. 2-ое изд. перераб. и доп. под редакцией доктора физико-математических наук Д. А. Кожевникова — М.: ФГУП Издательство «Нефть и газ» РГУ нефти и газа им. И.М. Губкина, 2004. — 368 с., ил.
- В. Блази. Справочник проектировщика. Строительная физика. М.: Техносфера, 2005. — 536 с.
- Енохович А. С. Справочник по физике. М.: «Просвещение», 1978. — 415 с. с ил.
- Строительная теплотехника СНиП II-3-79. Минстрой России — Москва 1995.
- Мустафаев Р. А. Теплофизические свойства углеводородов при высоких параметрах состояния. М.: Энергоатомиздат, 1991. — 312 с.
- Новиченок Н. Л., Шульман З. П. Теплофизические свойства полимеров. Минск, «Наука и техника» 1971. — 120 с.
- Шелудяк Ю. Е., Кашпоров Л. Я. и др. Теплофизические свойства компонентов горючих систем. М., 1992. — 184 с.